Giải Hóa 11 Bài 1 (Kết nối tri thức): Khái niệm về cân bằng hóa học
Giải Hóa 11 Bài 1: Khái niệm về cân bằng hóa học
Bài giảng Bài 1: Khái niệm về cân bằng hóa học - Kết nối tri thức
Giải Hóa 11 trang 6
Mở đầu trang 6 Hóa học 11: Phản ứng hoá học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng được với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng?
Lời giải:
Phản ứng hoá học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng được với nhau tạo thành chất đầu. Đối với các phản ứng này, người ta thường vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier để chuyển dịch cân bằng theo mong muốn nhằm thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng.
I. Phản ứng một chiều và phản ứng thuận nghịch
Hoạt động trang 6 Hóa học 11: Hai thí nghiệm sau đều được thực hiện ở cùng một điều kiện (bình kín dung tích 10 L, nhiệt độ 445 oC):
Thí nghiệm 1: Cho 1 mol H2 và 1 mol I2 vào bình kín. Kết quả thí nghiệm cho thấy dù thời gian phản ứng kéo dài bao lâu thì trong bình vẫn chỉ tạo ra 1,6 mol HI; còn dư 0,2 mol H2 và 0,2 mol I2.
Thí nghiệm 2: Thí nghiệm 2: Cho 2 mol HI vào bình. Kết quả thí nghiệm cũng cho thấy dù thời gian phản ứng kéo dài bao lâu thì trong bình vẫn chỉ tạo ra 0,2 mol H2 và 0,2 mol I2; còn dư 1,6 mol HI.
Thực hiện yêu cầu sau:
a) Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm 1 và thí nghiệm 2.
b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Giải thích.
Lời giải:
a) Phương trình hoá học của các phản ứng xảy ra:
- Trong thí nghiệm 1: H2(g) + I2(g) ⇌ 2HI(g).
- Trong thí nghiệm 2: 2HI(g) ⇌ H2(g) + I2(g).
b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Do hai phản ứng trên là phản ứng thuận nghịch, trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Giải Hóa 11 trang 8
Câu hỏi 2 trang 8 Hóa học 11: Phản ứng xảy ra khi cho khí Cl2 tác dụng với nước là một phản ứng thuận nghịch. Viết phương trình hoá học của phản ứng, xác định phản ứng thuận, phản ứng nghịch.
Lời giải:
Phương trình hoá học của phản ứng xảy ra khi cho khí Cl2 tác dụng với nước:
Cl2(aq) + H2O(l) ⇌ HCl(aq) + HClO(aq)
Phản ứng thuận: Cl2 + H2O → HCl + HClO.
Phản ứng nghịch: HCl + HClO → Cl2 + H2O.
Câu hỏi 3 trang 8 Hóa học 11: Nhận xét nào sau đây không đúng?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
Lời giải:
Đáp án đúng là: C
Giải thích: Phản ứng 1 chiều là phản ứng xảy ra hoàn toàn.
II. Cân bằng hoá học
Hoạt động trang 8 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g).
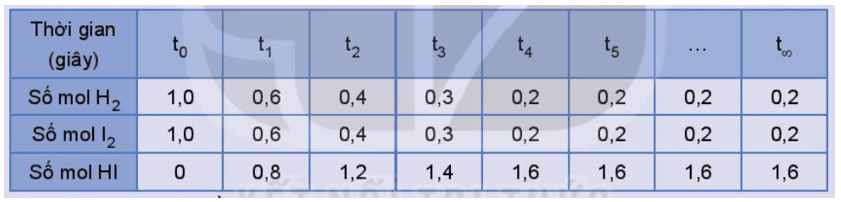
Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong Bảng 1.1 dưới đây:
Bảng 1.1. Số mol các chất trong bình phản ứng của thí nghiệm 1 thay đổi theo thời gian
Thực hiện các yêu cầu:
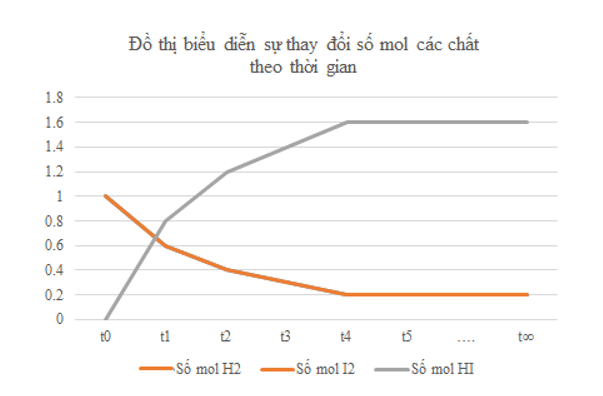
a) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian.
b) Từ đồ thị, nhận xét về sự thay đổi số mol của các chất theo thời gian.
c) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản).
d) Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng không thay đổi nữa?
Lời giải:
a)
b) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm chưa có, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận: vthuận =
- Đối với phản ứng nghịch: vnghịch =
Dự đoán:
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian.
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian.
d) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng thì số mol các chất trong hệ phản ứng không thay đổi nữa.
Giải Hóa 11 trang 9
Câu hỏi 4 trang 9 Hóa học 11: Cho phản ứng: 2HI(g) ⇌ H2(g) + I2(g)
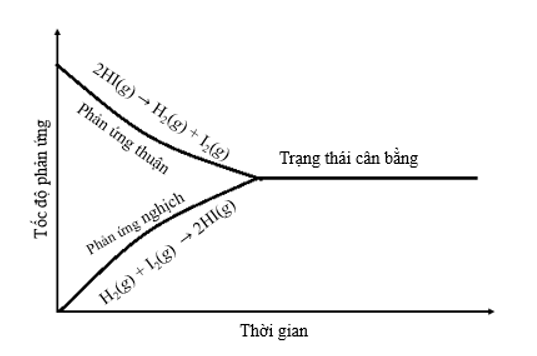
a) Vẽ dạng đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian.
b) Xác định trên đồ thị thời điểm phản ứng trên bắt đầu đạt đến trạng thái cân bằng.
Lời giải:
a) Dạng đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian:
b) Tại thời điểm số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa thì phản ứng đạt trạng thái cân bằng.
Câu hỏi 5 trang 9 Hóa học 11: Cho các nhận xét sau:
a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
c) Ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu.
d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
A. (a) và (b).
B. (b) và (c).
C. (a) và (c).
D. (a) và (d).
Lời giải:
Đáp án đúng là: D
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Hoạt động trang 9 Hóa học 11: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
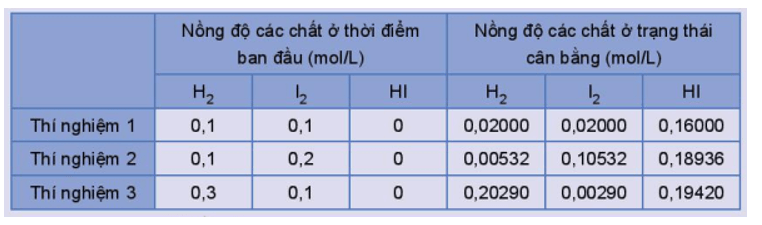
Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 oC với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2.
Bảng 1.2. Nồng độ các chất của phản ứng H2(g) + I2(g) ⇌ 2HI(g) ở thời điểm ban đầu và ở trạng thái cân bằng.
Tính giá trị ở mỗi thí nghiệm, nhận xét kết quả thu được.
Lời giải:
Giá trị hằng số cân bằng ở mỗi thí nghiệm:
- Thí nghiệm 1:
- Thí nghiệm 2:
- Thí nghiệm 3:
Nhận xét: Hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
Giải Hóa 11 trang 10
Câu hỏi 6 trang 10 Hóa học 11: Viết biểu thức hằng số cân bằng cho các phản ứng sau:
a) Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) ⇌ 2NH3(g)
b) Phản ứng nung vôi: CaCO3(s) ⇌ CaO(s) + CO2(g)
Lời giải:
Biểu thức hằng số cân bằng của các phản ứng:
a) KC =
b) KC = [CO2]
Chú ý:
Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng.
Câu hỏi 7 trang 10 Hóa học 11: Ammonia (NH3) được điều chế bằng phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g)
Ở toC, nồng độ các chất ở trạng thái cân bằng là:
[N2] = 0,45 M; [H2] = 0,14 M; [NH3] = 0,62 M.
Tính hằng số cân bằng KC của phản ứng trên tại t oC.
Lời giải:
Hằng số cân bằng KC của phản ứng tại t oC là:
KC = =
III. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hoá học
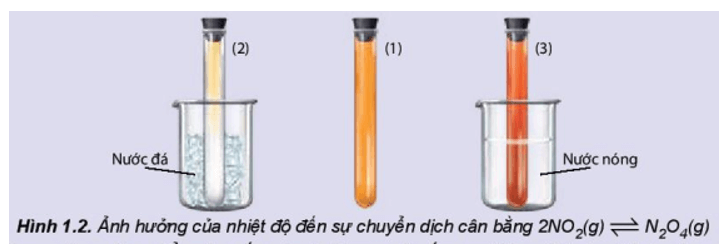
Thí nghiệm 1 trang 10 Hóa học 11: Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
Chuẩn bị: 3 ống nghiệm chứa khí NO2 nút kín có màu giống nhau, cốc nước đá, cốc nước nóng.
Tiến hành:
- Ống nghiệm (1) để so sánh.
- Ngâm ống nghiệm (2) vào cốc nước đá trong khoảng 1 - 2 phút.
- Ngâm ống nghiệm (3) vào cốc nước nóng trong khoảng 1 - 2 phút.
Lưu ý: NO2 là một khí độc, chú ý nút kín ống nghiệm.
Quan sát sự thay đổi màu sắc của khí trong các ống nghiệm và hoàn thành vào vở theo mẫu bảng sau:
Lời giải:
Tác động
Hiện tượng
Chiều chuyển dịch cân bằng (thuận/ nghịch)
Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt)
Tăng nhiệt độ
Màu khí trong ống nghiệm đậm dần lên
Nghịch
Thu nhiệt
Giảm nhiệt độ
Màu khí trong ống nghiệm nhạt dần đi
Thuận
Toả nhiệt
Giải Hóa 11 trang 13
Câu hỏi 8 trang 13 Hóa học 11: Cho các cân bằng sau:
CaCO3(s) ⇌ CaO(s) + CO2(g)
2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Lời giải:
1. Cân bằng: CaCO3(s) ⇌ CaO(s) + CO2(g)
⇒ Chiều thuận thu nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
2. Cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g)
⇒ Chiều thuận toả nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
Câu hỏi 9 trang 13 Hóa học 11: Ester là hợp chất hữu cơ dễ bay hơi, một số ester được dùng làm chất tạo mùi thơm cho các loại bánh, thực phẩm. Phản ứng điều chế ester là một phản ứng thuận nghịch:
CH3COOH(l) + C2H5OH(l) ⇌ CH3COOC2H5(l) + H2O(l)
Hãy cho biết cân bằng trên chuyển dịch theo chiều nào nếu
a) Tăng nồng độ của C2H5OH.
b) Giảm nồng độ của CH3COOC2H5.
Lời giải:
a) Tăng nồng độ của C2H5OH, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm nồng độ của C2H5OH.
b) Giảm nồng độ của CH3COOC2H5, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm tăng nồng độ CH3COOC2H5.
Giải Hóa 11 trang 14
Câu hỏi 10 trang 14 Hóa học 11: Cho các cân bằng sau:
a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Lời giải:
a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều nghịch, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
Câu hỏi 11 trang 14 Hóa học 11: Trong công nghiệp, khí hydrogen được điều chế như sau:
Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt):
C(s) + H2O(g) ⇌ CO(g) + H2
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để các cân bằng (1), (2) chuyển dịch theo chiều thuận.
b)Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 - 5 lần) so với khí carbon monoxide. Giải thích.
c) Nếu tăng áp suất, cân bằng (1), (2) chuyển dịch theo chiều nào? Giải thích.
Lời giải:
a)
Cân bằng 1: C(s) + H2O(g) ⇌ CO(g) + H2(g)
⇒ Chiều thuận thu nhiệt.
Vậy để cân bằng (1) chuyển dịch theo chiều thuận cần tăng nhiệt độ của hệ.
Cân bằng 2: CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
⇒ Chiều thuận toả nhiệt
Vậy để cân bằng (2) chuyển dịch theo chiều thuận cần giảm nhiệt độ của hệ.
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 - 5 lần) so với khí carbon monoxide. Do:
+ Tăng lượng hơi nước ⇒ cân bằng chuyển dịch theo chiều thuận (tức chiều làm giảm lượng hơi nước) ⇒ tăng hiệu suất thu khí hydrogen.
+ Ngoài ra, hơi nước có giá thành rẻ hơn và không độc hại so với sử dụng lượng dư carbon monoxide.
Câu hỏi 12 trang 14 Hóa học 11: Trong cơ thể người, hemoglobin (Hb) kết hợp với oxygen theo phản ứng thuận nghịch được biểu diễn đơn giản như sau:
Hb + O2 ⇌ HbO2
Ở phổi, nồng độ oxygen lớn nhất nên cân bằng trên chuyển dịch sang phải, hemoglobin kết hợp với oxygen. Khi đến các mô, nồng độ oxygen thấp, cân bằng trên chuyển dịch sang trái, giải phóng oxygen. Nếu thiếu oxygen ở não, con người có thể bị đau đầu, chóng mặt.
a) Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelie, em hãy đề xuất biện pháp để oxygen lên não được nhiều hơn?
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Dựa vào cân bằng trên, em hãy giải thích hiện tượng này.
Lời giải:
a) Để oxygen lên não nhiều hơn thì hàm lượng oxygen hít vào phổi cũng phải nhiều hơn. Một số biện pháp đề xuất để oxygen lên não nhiều hơn:
+ Tập thể dục và hít thở đúng cách.
+ Giảm lo âu, căng thẳng và có chế độ dinh dưỡng hợp lí.
+ Không hút thuốc lá, tránh xa nơi có khói thuốc.
+ Bảo vệ môi trường không khí trong lành, tránh ô nhiễm không khí.
+ Trồng nhiều cây xanh…
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Do ở trên núi cao, hàm lượng oxygen loãng, dẫn đến khi đến các mô cân bằng: Hb + O2 ⇌ HbO2 chuyển dịch theo chiều nghịch, giải phóng oxygen.
Lý thuyết Khái niệm về cân bằng hóa học
1. Phản ứng một chiều và phản ứng thuận nghịch
a. Phản ứng một chiều
- Phản ứng một chiều là phản ứng xảy ra theo một chiều trong cùng điều kiện. Phương trình hoá học của phản ứng một chiều được biểu diễn bằng một mũi tên chỉ chiều phản ứng.
Ví dụ: NaOH + HCl → NaCl + H2O
b. Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
- Phương trình hoá học của phản ứng thuận nghịch được biểu diễn bằng hai nửa mũi tên ngược chiều nhau. Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
- Trong thực tế, các phản ứng thuận nghịch xảy ra không hoàn toàn bởi vì trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Ví dụ: Cl2 + H2O ⇌ HCl + HClO
2. Cân bằng hóa học
a. Trạng thái cân bằng
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau để tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau để tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cần bằng, nồng độ các chất không thay đổi.
b. Hằng số cân bằng
* Biểu thức của hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát aA + bB ⇌ cC + dD:
Ở trạng thái cân bằng, hằng số cân bằng (Kc) của phản ứng được xác định theo biểu thức:
Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng. a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng. Thực nghiệm cho thấy hằng số cân bằng Kc của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng. Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng.
* Ý nghĩa của hằng số cân bằng
Hằng số cân bằng Kc phụ thuộc vào bản chất của phản ứng và nhiệt độ. Từ biểu thức xác định hằng số cân bằng Kc, ta có thể thấy rằng: Kc càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại. Kc càng nhỏ thi phản ứng nghịch càng chiếm ưu thế hơn.
3. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
a. Ảnh hưởng của nhiệt độ
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phân ứng thu nhiệt ( Ar, Ho298> 0), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại
b. Ảnh hưởng của nồng độ
Khi tăng nồng độ một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
c. Nguyên lý chuyển dịch cân bằng Le Chatelier
Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Nguyên lí chuyển dịch cân bằng Le Chatelier có ý nghĩa rất lớn khi được vận dụng vào kĩ thuật công nghiệp hoá học. Người ta có thể thay đổi các điều kiện để chuyển dịch cân bằng theo chiều mong muốn, làm tăng hiệu suất của phản ứng
Sơ đồ tư duy Khái niệm về cân bằng hóa học
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 2: Cân bằng trong dung dịch nước
Bài 3: Ôn tập chương 1
Bài 4: Nitrogen
Bài 5: Ammonia. Muối ammonium
Bài 6: Một số hợp chất của nitrogen với oxygen
Link nội dung: https://caohockinhte.edu.vn/bai-1-hoa-11-a60106.html